ppv眼科_ppv眼科医学上是什么意思
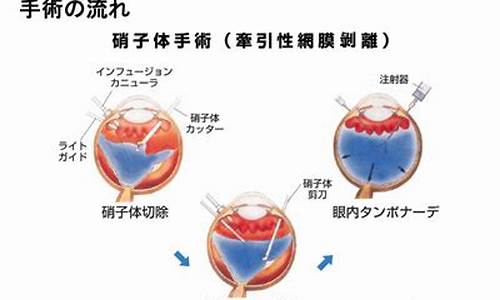
医学ppv就是玻璃体切割术,是眼科里比较难的一种手术,眼内炎、外伤及眼底病所致玻璃体出血、巨大裂孔视网膜脱离、后极部裂孔视网膜脱离等疾病需要做PPV手术。
玻璃体混浊严重会牵拉视网膜脱落,可以通过玻璃体切割手术改善,避免视网膜脱落。术后需要趴着休息。PPV手术对医生的要求很高,慎重选择医院、医生。
玻璃体是眼内屈光间质的主要组成部分,除此之外还有其他的功能,如:
1、胚胎期对眼球的发育起重要作用;
2、保持玻璃体腔高度透明,对光线散射极少;
3、对晶状体、视网膜等周围组织有支持、减震作用;具有代谢作用,有主动转运过程;
4、有屏障作用,细胞和大分子不易侵入玻璃体。
以上内容参考?百度百科-玻璃体?百度百科-玻璃体切割术
抗原和相应的抗体在动物体内或体外都能发生特异性结合反应,这种反应称为抗原抗体反应,习惯上把体内的抗原抗体反应称为免疫反应,体外的抗原抗体反应称为血清学反应,因为抗体主要存在于血清中。
血清学反应可以用已知的抗体检查未知的抗原,也可用已知抗原测定未知的抗体。人们根据抗体能与相应抗原发生反应并出现可见的抗原—抗体复合物的原理,设计了许多血清学诊断方法,不仅可以检测动物体内乃至体外的病原微生物,或其抗原性成分,而且还可以测定动物机体对病原微生物的侵袭或对其抗原成分的免疫反应。在抗原—抗体复合物成不可见状态时,可以通过琼脂扩散、凝集实验以及酶标记等指示系统,使其变为可见或可测状态。
目前已知的血清学诊断方法很多,现仅介绍几种在目前条件下规模化猪场通过学习都能做到的诊断方法:
(1)凝集试验猪病诊断过程中常用的操作方法有以下几种:
①全血平板凝集试验实践中主要用于细菌性疾病的抗体检测和抗原(经分离培养后)的鉴定。现举例用已知猪丹毒抗原(丹毒杆菌的纯培养液)测定被检猪血清中的抗体。其操作步骤如下:
a.材料猪丹毒凝集抗原,玻片,9号针头,酒精棉球,酒精灯,铂耳(取血环)等。b.操作用铂耳取已知抗原1滴,置于玻片上。用酒精棉球擦拭针头,铂耳在酒精灯上灼烧消毒。用针头刺破被检猪的耳静脉,以铂耳取血与玻片上的抗原等量混合,在2~3分钟内观察结果。c.结果判定出现颗粒状的凝集,为阳性反应。否则为阴性。
②试管凝集试验是一种定量法,用于测定被检血清或其他体液中有否某种抗体及其效价,可做临床的诊断,或用于流行病学监测。在猪场中,本法常用于猪布氏杆菌病的诊断。
A.材料布氏杆菌病试管凝集抗原(1∶20倍稀释),布氏杆菌病阳性血清、阴性血清(1∶25倍稀释),稀释液(0.5 %石炭酸生理盐水),灭菌小试管,1毫升吸管,试管架,待检血清等。B.操作取试管7支置于试管架上,设阳性和阴性血清及抗原对照各1支,测定管4支,以后每增加1个样品,只需增加4支测定管。
按表10示意稀释血清,加抗原,完成后每支试管内应含1毫升液体。
表10 布氏杆菌试管凝集反应(单位:毫升)
试管号 1 2 3 4 5 6 7血清稀释倍数 1∶25 1∶50 1∶100 1∶200 阳性血清对照1∶25 阴性血清对照1∶25 抗原对照0.5%石炭酸生理盐水 1.5 0.5 0.5 0.5 0.5 0.5 0.5待检血清 0.5 0.5 0.5 0.5 抗原(1∶20稀释) 0.5 0.5 0.5 0.5 0.5 0.5 0.5弃0.5 弃0.5加入抗原后,将试管充分振荡,置于37℃温箱反应24小时后,判定结果。C.判定标准“-” 液体均匀混浊,管底无凝集物,不凝集。
“+” 液体透明度较差,管底有少量凝集物,为25%凝集。
“++” 液体中等浑浊,管底有中等量的伞状沉淀,50%菌体凝集。
“+++” 液体几乎透明,管底有明显伞状沉淀,75%菌体凝集。
“++++” 液体完全透明,管底出现大片的伞状沉淀,100%菌体凝集。
结果判定:已出现50%菌体凝集的血清最高稀释度为该血清的凝集价。在检测猪布氏杆菌病时,血清凝集价在1∶50以上时,可判为阳性反应。若凝集价为1∶25,则为可凝集(需重复试验1次)。如猪群中基本无阳性反应。则凝集价1∶25也可判为阴性。
③间接红细胞凝集实验(简称间接血凝试验)
该试验能大大提高反应的敏感性。用抗体致敏红细胞检测相应的抗原,称为反向间接血凝试验;反之,称为正向间接血凝实验。在猪病的诊断中,常用本法对猪口蹄疫、水泡病、猪瘟、传染性胸膜肺炎等疾病抗原的鉴定,或抗体的检测。现举例猪口蹄疫的抗体检测(正向间接血凝),操作步骤如下:
A.目的检测被检血清样品中猪口蹄疫抗体的效价。B.材料猪口蹄疫(O型)正向间接血凝标准致敏红细胞(由兰州兽医研究所提供),标准阳性阴性血清,稀释液,96孔“V”形有机玻璃微量血凝板,微量加样器,滴头,被检血清等。C.操作将待检血清置60℃水浴中灭活30分钟,用微量加样器对血凝板上的每孔加入25微升稀释液,取25微升待检血清加到第一孔,用加样器以吸入与排出的动作混合3~4次,取出25微升放入第二孔混匀,依次到第九孔,取出25微升弃掉。血清稀释度从第一到第九孔分别为1∶2,1∶4,1∶8,1∶16,1∶32,1∶64,1∶128,1∶256,1∶512(第一排的10~12孔设阳性血清对照、阴性血清对照和抗原对照)。每孔加入25微升致敏红细胞,振荡1~2分钟,置37℃温箱或室1~2小时或更长时间,然后判定结果。D.判定标准“-” 红细胞沉底,呈圆点状,不凝集。
“+” 红细胞大部分集中于中央,周围只有少数凝集,即25%凝集。
“++” 红细胞呈薄层凝集,中心致密,边缘分散,即50%凝集。
“+++” 红细胞凝集程度较上有所增加,即75%凝集。
“++++” 红细胞呈薄层凝集,布满整个孔底或边缘,蜷曲呈荷包蛋边状,即100%凝集。
结果判定:以出现50%凝集(++)的血清最高稀释度,为该血清的间接血凝价。
④血凝(HA)与血凝抑制(HI)试验在猪的传染病中,细小感染、乙型脑炎、伪狂犬病等,适宜进行血凝和血抑试验,本试验以检测猪细小血清抗体为例,介绍如下:
A.材料猪细小浓缩诊断抗原,豚鼠沉积红细胞配成的0.5%悬液。稀释液、标准阳性和阴性血清、被检血清、96孔V形有机玻璃微量血凝板、25~50微升微量移液管、微量振荡器、普通离心机等。B.试验方法a.血凝(HA)试验用滴管在96孔血凝板上以第一孔至试验所需要稀释倍数孔,每孔滴加稀释液25微升,用移液器从第一孔开始依次稀释,置微量振荡器上振荡15秒,最后每孔滴加0.5%豚鼠红细胞25微升,振荡30分钟,置室温(20℃左右)1小时后判定。b.血凝抑制(HI)试验被检猪血清先经56℃、30分钟灭活,然后加入50%豚鼠红细胞(最终浓度)和等量的高岭土,摇匀后放室温15分钟,经2000转/分离心10分钟,取上清液以除掉血清中非特异性的凝集素和抑制素,然后用稀释液将每份处理过的血清1∶5~1∶10至240倍比稀释,在向每孔加入等量4个血凝单位的标准血凝素(抗原),混匀后置室温1小时,加入新配制的0.5%豚鼠红细胞悬液,混匀后置室温2小时,判定结果,同时设阳性、阴性血清及红细胞和抗原的对照,HI抗体滴度≥1∶20者为阳性,猪感染PPV后7天左右可检出HI抗体,12~14天可达1∶~5000。
⑤乳胶凝集试验(LAT)
本法在猪病中主要作用于伪狂犬病和猪萎缩性鼻炎的诊断,是用其或细菌致敏乳胶抗原来检测被检猪的血清、全血或乳汁中的抗体,具有简便、快速、特异、敏感的优点。
A.材料伪狂犬致敏乳胶抗原,伪狂犬病阳性血清、阴性血清、稀释液,玻片,吸头,被检血清或全血或乳汁(通常初乳,经3000转/分钟离心,取上清液做待检样品)。B.试验方法a.定性试验取被测样品(血清,全血或乳汁)、阳性血清、阴性血清、稀释液各1滴,分置于玻片上,各加乳胶抗原1滴,用牙签混匀,搅拌并摇动1~2分钟,于3~5分钟内观察结果。b.定量试验先将血清在微量反应板或小试管内作连续倍比稀释,各取1滴依次滴加于乳胶凝集反应板上,另设对照(同上),随后各加乳胶抗原1滴。如上搅拌并摇动,然后判定。
C.结果判定首先对照组要出现如下结果,本试验才能成立:阳性血清加抗原呈“++++”,阴性血清加抗原呈“-”,抗原加稀释液呈“-”。
“++++”全部乳胶凝集,颗粒聚集于液滴边缘,液体完全透明。
“+++”大部分乳胶凝集,但颗粒明显,液体稍混浊。
“++”约50%乳胶凝集,但颗粒较细,液体较混浊。
“+”仅有少许凝集,液体混浊。
“-”液滴呈原有的均匀乳状。
以出现“++”以上凝集者,判为阳性凝集。
注意事项:试剂盒应在2~8℃冷暗处保存,暂定1年。乳胶抗原为乳白色状液体,如出现分层,使用前轻轻摇匀。
(2)沉淀实验具体方法有多种,如环状沉淀实验、琼脂扩散实验和免疫电泳等。在猪病的诊断中,目前最常用的是琼脂扩散实验,现以检测伪狂犬病的抗体为例,将其操作方法介绍如下:
A.材料伪狂犬病标准抗原,阳性血清,阴性血清,待检血清(56℃灭能30分钟),生理盐水,打孔器,微量移液器,培养皿,琼扩琼脂(配制方法:含有0.1%石炭酸的磷酸缓冲盐水,加入1%的优质琼脂,在沸水中融化均匀,若有杂质,须用纱布过滤,然后分装于盐水瓶内,保存备用)。B.操作a.浇琼脂板和打孔将已融化的琼脂趁热倒入平皿,制成3毫米厚的琼脂板,待凝固后进行打孔。一组共7个孔,中间1孔,孔径4毫米,孔距3毫米。用打孔器打孔,剔出孔内的琼脂然后将琼脂板在酒精灯上来回过2~3次,使琼脂与玻板之间的空隙封闭。b.向孔内加样中央孔加抗原,外周孔第1,5孔加阳性和阴性血清作对照,第2,3,4,6孔加待检血清。将加完样的琼脂平皿加上盖子,置37℃恒温箱扩散24~36个小时,然后判定结果。C.结果判定首先检查标准阳性血清孔和抗原孔之间是否出现明显的致密的白色沉淀线,而阴性孔则不出现,只有在对照组出现正确结果的前提下,被检孔才可参照标准判定。
注意事项:
第一,琼扩所用的琼脂必须是优质的琼脂粉,若用普通的琼脂条,应事先净化精制。精制的简易方法是:取条状琼脂24克,加蒸馏水1000毫升,在沸水中融化,趁热倒入搪瓷盘中,待冷却后切成1平方厘米大小的琼脂块,用蒸馏水或无离子水浸泡2~3天,每天换水4~5次,然后将处理好的琼脂块隔水融化,加入0.1%石炭酸磷酸缓冲盐水,配成1%琼脂。
第二,制备琼脂板应在水平台上进行,防止薄厚不匀。板的厚度要求一致(7.5厘米的平皿,用15毫升琼脂液)。浇制时防止产生气泡。平皿浇制的琼脂板在4℃冰箱内可保存15天。
第三,打孔的孔径、孔距力求准确、合适。
第四,孔中滴加抗原和血清时,孔内必须加满而又不能外溢。加样时不能带进小气泡。
(3)酶联免疫吸附试验(ELISA)
它是根据抗原与抗体特异性结合的功能,以酶做标记物,利用酶对底物具有高效催化作用的原理而设计的。它既可以用于抗原的诊断,也可进行血清抗体的检测,可达到定性和定量的目的。已广泛地用于传染性疾病的诊断,血清流行病学调查和抗体水平的评价等。
目前在兽医防治的研究和实践中,对于猪瘟、伪狂犬病、繁殖障碍与呼吸综合征、流行性腹泻、旋毛虫病、猪气喘病等疾病,均用免疫酶技术进行病原诊断、抗体检测和血清学流行性调查,并且已成为规模化猪场化验室工作的一项重要内容。利用免疫酶技术测定抗原和抗体的方法很多,下面简要介绍3种适合猪场使用的免疫酶技术。
①斑点酶联免疫吸附实验(Dot—ELISA)
A.材料硝酸纤维滤膜(孔径0.45微米),0.01摩/升、pH7.2的磷酸盐缓冲盐水,封闭液(磷酸盐缓冲盐水加入10%马血清或0.1%明胶),30%双氧水(H2O2),3,3′-二甲基联苯胺(DAB)抗原液,阴性对照,待检液,待检血清,阳性血清及阴性血清,酶标兔抗猪免疫球蛋白G(IgG),0.05摩/升三羟甲氨基甲烷—盐酸缓冲液,洗涤液(磷酸盐缓冲盐水加入0.05%吐温-20)。B.检测抗原操作第一,硝酸纤维薄膜(NCM)的处理:在滤膜上划6毫米×6毫米的方格,在方格中央用蘸水笔末端压成圆形痕迹。置于蒸馏水中浸泡10分钟,取出后晾干备用。
第二,点样:取1毫升待检液在硝酸纤维滤膜圆圈内点样,同时设立阳性与阴性对照,自然干燥或置于37℃温箱中干燥。
第三,封闭:将硝酸纤维滤膜置于封闭液中,37℃、30分钟,用洗涤液洗涤1次,约3分钟。
第四,加猪阳性血清,将硝酸纤维薄膜置于猪阳性血清中,37℃作用1小时,取出用洗涤液洗涤3次,每次3分钟。
第五,加酶标兔抗猪免疫球蛋白G,37℃作用1小时,然后洗涤3~4次,每次3分钟。
第六,加底物溶液(0.05摩/升三羟甲氨基甲烷—盐酸缓冲液100毫升,加3,3′-二甲基联苯胺40毫克,30%双氧水50微升),作用5~10分钟。
第七,终止显色,将硝酸纤维滤膜置于蒸馏水中冲洗2~3分钟。
第八,自然干燥,或37℃下干燥。
第九,判定标准:
“-” 不呈现斑点,与阴性对照相同。
“+” 斑点较弱或沉淀内有不均质的棕色点。
“++” 斑点浅棕色,对比度清晰。
“+++” 介于++和+++两者之间。
“++++”斑点深棕色,背景白色。
出现阳性反应的血清最高稀释度为该血清的Dot—ELISA效价。
第十,注意事项:试验中的点样抗原、血清及酶标抗体的稀释度,应根据预备试验确定;试验中应使用不溶性供氢体;如3,3′-二甲基联苯胺,4-氯-1-萘酚等,不能使用可溶性供氢体;根据试验的目的要求,确定检测抗原或抗体;封闭液可使用异种动物血清、牛血清蛋白(BSA)或明胶溶液等进行封闭,根据预备试验选择最佳封闭条件。C.检测抗体操作第一,硝酸纤维滤膜的处理,同检测抗原。
第二,点样,取已知抗原液点样,自然晾干或37℃干燥。
第三,封闭,同检测抗原。
第四,将点样后的硝酸纤维滤膜按点样格子剪成小块,置入系列稀释液的待检血清(1∶10,1∶50,1∶100,1∶200,1∶400,1∶800,1∶1600,1∶3200,1∶6400,1∶12800)中,同时设立阳性和阴性血清对照,37℃作用1小时,然后用洗涤液洗涤3次,每次3分钟。
第五,以下均同检测抗原第六、第七、第八、第九、第十项操作。
②酶联免疫吸附实验(ELISA)
现介绍猪病诊断常用的两种方法:
A.间接法将已知抗原吸附(或称包被)与固相载体,孵育后洗去未吸附的抗原,随后加入含有特异性抗体的被检血清,感作后洗涤未起反应的物质,加入酶标抗同种球蛋白(如被检血清是猪血清,则需用抗猪球蛋白),感作后再经洗涤,加入酶底物,底物分解后出现颜色变化,颜色变化的速度及程度,与样品中的抗体量有关,即样品中的抗体愈多,颜色出现愈快、愈深。
a.材料0.05摩/升、pH9.6碳酸盐缓冲液,稀释液用0.01摩/升、pH7.2磷酸缓冲盐水(含0.13摩/升氯化钠,0.5%犊牛血清),洗涤液用0.01摩/升、pH7.2磷酸盐缓冲盐水(含0.13摩/升氯化钠,0.05%吐温-20),30%双氧水,邻苯二胺(OPD),pH5.0磷酸二氢钠—柠檬酸缓冲液,2摩/升硫酸,抗原,阳性血清,阴性血清,待检血清,酶标兔抗猪免疫球蛋白,40孔聚苯乙烯联板,酶联免疫检测仪。b.操作第一,用碳酸盐缓冲液配置一定浓度的抗原包被液包被酶联板,每孔100微升,置37℃条件下2小时,或在4℃冰箱内过夜。
第二,倾去孔内液体,用洗涤液加满各孔,洗涤3次,每次3分钟,然后倾尽洗涤液。
第三,除调零孔外,其余孔加入用稀释液稀释的待检血清,每孔100微升,同时设立阳性、阴性血清对照,置37℃下反应1.5小时。
第四,抗体效价测定。将待检血清进行血清进行倍比稀释,每份血清加两排孔,即同一稀释度的血清加上下相邻的两个孔,每孔100微升,凋零孔不加血清。同时设立阳性、阴性血清对照。置37℃反应1.5小时。
第五,洗涤同第二。
第六,除调零孔外,每孔加入酶标记兔抗猪免疫球蛋白G 100微升,置37℃下反应1.5小时。
第七,洗涤同第二。
第八,每孔加入新配置的底物溶液(取邻苯二胺40毫克,溶于100毫升pH5.0的磷酸盐—柠檬酸缓冲液,临用前加入30%双氧水0.15毫升)100微升,室温下观察显色(5~30分钟)。
第九,每孔加入50微升,2摩尔/升硫酸终止反应。
第十,用酶联免疫检测仪测定每孔490纳米波长的光密度(OD)值。
B.夹心法本法是检测抗原的方法,将特异性免疫球蛋白吸附于固相载体表面,然后加入含有抗原的溶液,使抗原和抗体在固相表面形成复合物,洗除多余的抗原,再加入酶标记的特异性抗体,感作后冲洗,加入酶的底物,颜色的改变与被测样品中的抗原量成正比。
a.材料同间接法。b.操作(以检测猪瘟抗原为例)
第一,抗体包被:将一定溶度的猪瘟高免血清(用碳酸盐缓冲液进行稀释)包被酶联板,每孔100微升,置37℃下反应2小时,或4℃冰箱中过夜。
第二,洗涤:同间接法。
第三,加被检样品,除调零孔外,每份样品加2个孔,每孔加100微升,同时设立阳性抗原、阴性抗原对照,酶结合物对照(抗体加磷酸盐缓冲盐水加酶结合物),置37℃下反应1.5~2小时。
第四,洗涤,同第二。
第五,加底物溶液,同间接法第八。
第六,同间接法第九。
第七,同间接法第十。
C.结果判定常用的判定方法有3种。
阴阳性表示法:待检样本吸收值:规定吸收值≥0.2~0.4为阳性。规定吸收值等于阴性样本平均吸收值加SD(标准差)。
阳性阴性比(P/N)法:样本吸收值/阴性样本平均吸收值≥2~3者为阳性。
终点表示法:以出现阳性反应的样本最高稀释度,为该样本的滴度。D.注意事项第一,包被过程中以高pH和低离子强度的条件为佳,包被浓度在1~100毫克/毫升选择最佳浓度。
第二,血清或抗原稀释液应含5%~10%异种动物血清,或1%牛血清白蛋白,或0.5%明胶,以起封闭作用,防止非特异性反应,否则应在第二与第三步之间加封闭液进行封闭。
第三,洗涤要充分,酶结合物应按照要求进行稀释和使用,底物溶液一定要现配现用。
第四,显色时阴性对照刚出现微**时,应立即终止反应。
第五,用阳性阴性比方法判定结果时,阴性对照孔若小于0.1,则易出现误判。
第六,用自动酶联仪检测时,应按仪器规定说明确定调零孔。
第七,同一稀释度2个孔的490纳米波长光密度值的平均值,为该稀释度的光密度值,对照孔应作同样处理。
③猪瘟单克隆抗体纯化酶联免疫吸附试验A.材料本试验的试剂盒由中国兽药监察所提供。本抗原包括猪瘟弱毒单抗纯化酶联抗原和猪瘟强毒单抗纯化酶联抗原,分别供检测经猪瘟弱毒疫苗免疫后产生的抗体和感染猪瘟强毒后产生的抗体之用。同时提供酶标抗体,阳性、阴性血清,酶联板及其他器材和试剂。B.试验方法第一,用包被液将猪瘟弱毒单抗纯化酶联抗原、猪瘟强毒单抗纯化酶联抗原各做100倍稀释,以100微升分别加入做好标记的酶联板孔中,置湿盒于4℃过夜。
第二,弃去孔内液体,用洗涤液冲洗板3次,每次间隔3~5分钟,拍干。
第三,用稀释液将待检血清作400倍稀释,每孔加入100微升,同时将猪瘟阳性阴性血清以100倍稀释作对照,37℃下培育1.5~2小时。
第四,重复第二步。
第五,用稀释液将兔抗猪免疫球蛋白G辣根过氧化物酶结合物作100倍稀释,每孔加入100微升,37℃下培育1.5~2小时。
第六,重复第二步。
第七,每孔加入底物溶液(每块板所需的底物溶液按邻苯二胺5毫克加底物缓冲液5毫升加30%双氧水18.75微升配制)100微升,室温下观察显色反应(一般阴性对照孔略微显色,立即终止反应,并以阴性孔作空白调零)。
第八,每孔加入终止液50微升,于酶联读书仪上测定490纳米波长的光密度(OD)。C.判定标准a.在猪瘟弱毒酶联板上光密度>0.2为猪瘟弱毒抗体阳性。
光密度<0.2为猪瘟弱毒抗体阴性。b.在猪瘟强毒酶联板上光密度≥0.5为猪瘟强毒抗体阳性。
光密度<0.5为猪瘟强毒抗体阴性。
D.注意事项第一,运输单纯纯化酶联抗原时,必须使用冰盒低温运输。
第二,配制洗涤液时,应使用新鲜蒸馏水或无离子水;每次洗板后,尽量不使孔中有残余液体,以免影响结果。
第三,底物溶液临用前配置,待邻苯二胺完全溶解于底物缓冲液后再加双氧水,混匀后立即加入孔中。
第四,终止反应后,应立即读数。200.猪场兽医检验室应配备哪些器材和试剂?
(1)设备类:猪场兽医检验室配备的主要设备有电冰箱、电热培养箱、电热干燥箱、台式离心机、超净工作台、高压灭菌锅、显微镜、蒸馏水器、微量血清振荡器、组织捣碎机等。
(2)器械类:猪场兽医检验室配备的主要器械有普通天平、研钵、铁三脚架、酒精灯、石棉网、试管架、接种棒、带盖搪瓷盘、铝饭盒、微量反应板(V型)、微量移液器(100微升、250微升)、普通剪刀、眼科剪刀、眼科镊子、长镊子、手术刀等。
(3)猪场兽医检验室配备的主要玻璃器材:有玻璃注射器、试管、刻度吸管、烧杯、三角烧瓶、玻璃漏斗、量筒、玻璃珠、载玻片、盖玻片等。
(4)试剂类:猪场兽医检验室配备的主要试剂有95%乙醇、氯化钠、氢氧化钠、碱性复红、结晶紫、沙黄、姬姆萨、甲醇、甲醛、草酸铵、甲基红、营养琼脂、麦康凯琼脂、SS琼脂、三糖铁琼脂、微量生化反应管、二甲苯、显微镜油、擦镜纸、常用猪病血清学诊断试剂盒等。
附录:猪的实用生理常数
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。