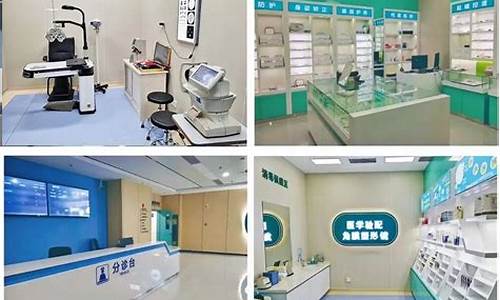
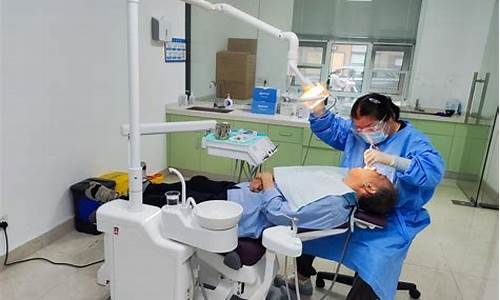
耳鼻喉科有哪些设备_耳鼻喉科主要检查项目

耳鼻喉 (ENT) 显微外科需要顶级成像质量和可视化效果。使用耳鼻喉科显微镜,专家们可以进行复杂、高精度但介入最少的耳鼻喉外科,实现理想的临床预后。
徕卡显微系统推出的耳鼻喉外科显微镜可在广泛的耳鼻喉显微外科工作中为专业医师提供丰富、适应性强的解决方案。这些显微镜可定制,也可与其他设备集成,包括双目镜筒、物镜镜头、手柄、支架等。
耳鼻喉科临床照明对于理想的可视环境至关重要,但过高的光强会对皮肤造成损伤,尤其是儿童的皮肤更加娇嫩脆弱。Leica Microsystems的创新照明管理系统有助于保护患者的皮肤和组织。当工作距离减小时,BrightCare Plus将自动降低光照强度,从而将患者灼伤的风险降至最低。内部照度计能够根据实际的灯泡输出来计算光强,而不是通过算法。
徕卡显微系统的解决方案能在显微外科治疗中为专业医师提供有力支持。徕卡的创新显微镜技术能增强景深,定位精准,可操控性强。
医疗器械分类目录:
1、基础外科手术器械显微外科手术器械
2、神经外科手术器械眼科手术器械
3、耳鼻喉科手术器械口腔科手术器械
4、胸腔心血管外科手术器械腹部外科手术器械
5、泌尿肛肠外科手术器械矫形外科(骨科)手术器械
6、妇产科用手术器械生育手术器械
7、注射穿刺器械烧伤(整形)科手术器械
8、普通诊察器械医用电子仪器设备
9、医用光学器具、仪器及内窥镜设备医用超声仪器及有关设备
10、医用激光仪器设备 医用高频仪器设备
11、物理治疗及康复设备中医器械
12、医用磁共振设备医用X射线设备
13、医用X射线附属设备及部件医用高能射线设备
14、医用核素设备医用射线防护用品、装置
15、临床检验分析仪器医用化验和基础设备器具
16、体外循环及血液处理设备植入材料和人工器官
17、手术室、急救室、诊疗室设备及器具口腔科设备及器具
18、病房护理设备及器具 消毒和灭菌设备及器具
19、医用冷疗、低温、冷藏设备及器具 口腔科材料
20、医用卫生材料及敷料医用缝合材料及粘合剂
21、医用高分子材料及制品介入器材
扩展资料:
(一)医疗器械备案是指食品药品监督管理部门对医疗器械备案人(以下简称备案人)提交的第一类医疗器械备案资料存档备查。
(二)实行备案的医疗器械为第一类医疗器械产品目录和相应体外诊断试剂分类子目录中的第一类医疗器械。
境内第一类医疗器械备案,备案人向设区的市级食品药品监督管理部门提交备案资料。进口第一类医疗器械备案,备案人向国家食品药品监督管理总局提交备案资料。香港、澳门、台湾地区医疗器械的备案,参照进口医疗器械办理。
(三)办理备案的进口医疗器械,应当在备案人注册地或者生产地址所在国家(地区)获得医疗器械上市许可。
备案人注册地或者生产地址所在国家(地区)未将该产品作为医疗器械管理的,备案人需提供相关证明文件,包括备案人注册地或者生产地址所在国家(地区)准许该产品合法上市销售的证明文件。
(四)境外备案人办理进口医疗器械备案,应当通过其在中国境内设立的代表机构或者指定中国境内的企业法人作为代理人办理。
(五)备案人应当编制拟备案医疗器械的产品技术要求。产品技术要求主要包括医疗器械成品的性能指标和检验方法。
(六)办理医疗器械备案,备案人应当按照相关要求(见附件1)提交备案资料,并对备案资料的真实性、完整性、合规性负责。
(七)备案资料符合要求的,食品药品监督管理部门应当当场予以备案。备案资料不齐全或者不符合规定形式的,应当一次告知需要补正的全部内容。对不予备案的,应当告知备案人并说明理由。
(八)对予以备案的医疗器械,食品药品监督管理部门应当按照相关要求的格式制作备案凭证(见附件2),并将备案信息表(见附件3)中登载的信息在其网站上予以公布。食品药品监督管理部门按照第一类医疗器械备案操作规范(见附件4)开展备案工作。备案人应当将备案号标注在医疗器械说明书和标签中。
(九)已备案的医疗器械,备案信息表中登载内容及备案的产品技术要求发生变化,备案人应当提交变化情况的说明及相关证明文件,向原备案部门提出变更备案信息。食品药品监督管理部门对备案资料符合形式要求的,应在变更情况栏中载明变化情况,将备案资料存档。
百度百科_一类医疗器械
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。